文章图片

随着间充质干细胞(MSCs)培养技术的推广 , 外泌体作为高科技概念产品迅速风靡细胞治疗和药妆行业 。 那么 , 如何看待“外泌体皮肤损伤修复中的作用”呢?
皮肤是一个复杂的器官 , 具有重要的身体屏障功能 , 且很容易受到各种各样的伤害 。 例如 , 急性创伤是由外伤或手术切口引起、慢性皮肤创伤是糖尿病常见的并发症 , 急性烧伤、寒冷、高温、干燥以及紫外线等都会使肌肤屏障受损 。
近年来的研究表明干细胞在再生医学中具有巨大的治疗潜力 , 通过分泌抗炎、抗纤维化和促血管生成活性的因子 , 如可溶性分子(生长因子、细胞因子)或细胞外囊泡(微粒子、外泌体)等来改善创面愈合过程 。 除了传统的使用干细胞治疗创伤的方法外 , 近年越来越多的研究表明外泌体发挥了无可替代的重要作用 , 其安全性、有效性更胜干细胞 , 即形成新的趋势——单独使用干细胞外泌体 。
一、什么是外泌体?
人们在20世纪60年代后期首次描述了在哺乳动物组织或液体中 , 有囊泡在细胞周围存在 。 1983年 , Pan和Johnstone从网织红细胞培养液中发现了一种膜性小囊泡 , 就此打开了外泌体世界的大门 , 1987年Johnstone将其命名为“外泌体(exosome)” 。 2011年 , 人们提出通用术语“胞外囊泡(extracellular vesicle)”来定义所有的由脂质双层包围的胞外结构 , 外泌体是胞外囊泡中的一种类型 。
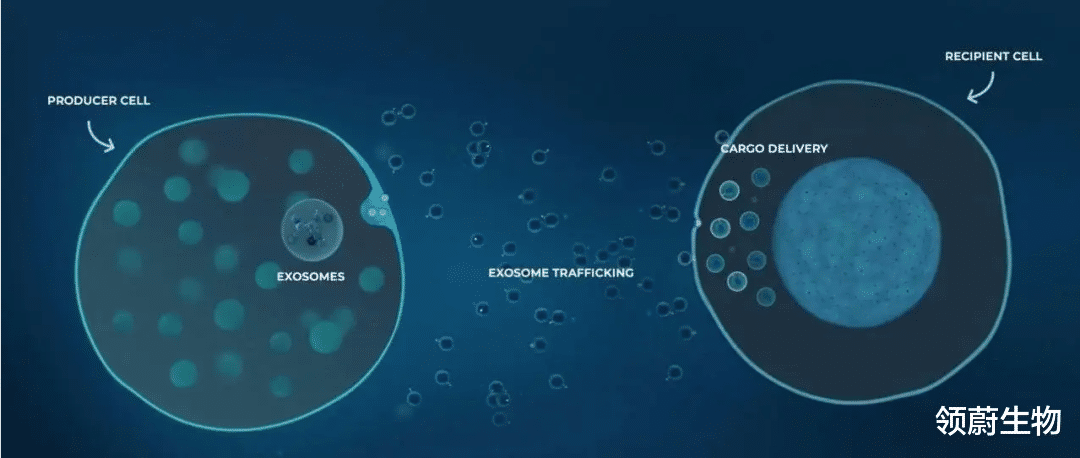
外泌体是一类直径30-150nm的微小囊泡 , 可以将脂类、碳水化合物、蛋白质、mRNA、miRNA等生物分子从一个细胞传递到另一个细胞 , 从而交换遗传信息、重编程宿主细胞 , 进行细胞间通讯 。
干细胞来源的外泌体可通过囊泡 , 将干细胞的精华部分——mRNA、miRNA、IncRNA及蛋白质等生物活性物质 , 打包运出干细胞体外 。 通过“细胞间高速公路”来“快递”到人体各个组织内 。
干细胞外泌体可以通过改变细胞外基质 , 改变受体细胞的转录组和蛋白质组 , 来调节细胞凋亡、生长、增殖和分化途径 。
因此 , 干细胞外泌体具有减少细胞凋亡、减轻炎症反应、促进血管生成、抑制纤维化、提高组织修复潜力等重要生物学功能 , 在调控组织再生方面存在良好的临床应用前景 。
二、外泌体如何产生?
开始 , 细胞膜内陷形成早期核内体;接着 , 细胞将颗粒物质释放到早期核内体中 , 进一步成熟形成晚期核内体;最后 , 晚期核内体与细胞膜特定部位融合后形成芽泡 , 将泡体中的外泌体释放到细胞外 。
外泌体可通过配体- 受体相互作用的方式粘附到受体细胞表面 , 亦可通过受体细胞内吞摄取或囊泡和细胞膜的直接融合使外泌体内容物释放到靶细胞内 。
外泌体发挥生物学效应的方式有哪里呢?主要有以下两种:
直接作用:外泌体表面的蛋白分子或脂质配体直接激活靶细胞表面的受体 , 产生信号复合体并激活胞内信号通路;
递送作用:外泌体可以与靶细胞的质膜融合或内吞直接进入细胞 , 将自身携带的蛋白质、核酸、脂质等活性分子带到细胞内 , 进而调控细胞的功能及生物学行为 。
三、外泌体的生物学特征
外泌体的电镜是鉴定外泌体形态大小的一个常规手段 , 电镜下呈典型的杯状形态 。 粒径大小40~100nm的囊泡样小体 。
间充质干细胞外泌体(MSC-exo) , 表达所有外泌体共同表达的相关标志物:细胞骨架蛋白质(微管蛋白和肌动蛋白) , 同时也表达MSCs的表面标志物(CD29/CD90/CD73) 。 MSC-exo中有独特微小核糖核酸 , 包括:miR-191/miR-222/miR-21/Let-7a(调节细胞增殖)、miR-222/miR-21/Let-7a(促血管生成)、miR-6087(促内皮分化)、miR-494(促肌肉生长)、miR-181c(减少炎症反应) 。 MSC-exo提取方法包括:超速离心法、基于尺寸大小的技术、免疫吸附的分离技术、沉淀法、基于微流控的分离技术 。
其中超速离心法是分离外泌体的标准方法 。 在4℃条件下依次以300G , 2000G , 10000G的转速离心 , 依次去除细胞和细胞碎片等 , 再以100000G超速离心得到外泌体 。 可根据外泌体密度使用连续梯度蔗糖密度梯度离心法 。
四、外泌体修复皮肤损伤机制
1、MSCs-exo促进成纤维细胞增殖
在皮肤损伤后第3 天后 , 成纤维细胞开始增殖产生细胞外基质(包括纤连蛋白 , I 型和III 型胶原蛋白等) 。 同时 , 上皮细胞开始增殖并向受伤区域边缘迁移 , 加速伤口闭合 , 减少皮肤感染 。 因此 , 细胞增殖和皮肤再上皮化对皮肤再生至关重要 。
推荐阅读
- 最新变化,21年的金秋之时,哈勃为我们带来四大行星的这些
- 蚀刻系统操作条件对晶片蚀刻速率和均匀性的影响的相关性
- 《暗夜博士:莫比亚斯》:索尼的蜘蛛侠衍生宇宙还有未来吗?
- 警告:外星生物可能会搭乘人类宇宙飞船,并侵袭地球
- 发育生物学试题及答案
- 世上已消失的4大人种,如果他们还存在的话,人的生存会受到威胁
- 29岁内蒙女孩白蕊,成为清华博士、女科学家,凭啥
- 小天才电话手表携手中国航天太空创想,Z8航天定制款预售开启!
- 动物生理学名词解释 简答整理版







