2022年3月1日 , 燃石医学(NASDAQ:BNR)宣布 , 公司自主研发的实体瘤微小残留病灶(Minimal Residual Disease/Molecular Residual Disease, 以下简称MRD)检测产品朗微?正式上市 。 朗微?根据每一位实体瘤患者基因变异图谱 , 定制个体化的MRD检测方案 , 可动态评估患者MRD状态 , 提示患者手术或其他根治性治疗后的复发风险 , 同时为预后评估和用药治疗提供指导 , 助力患者的全病程管理 。
【检测|【重磅上市】朗微:定制实体瘤患者专属“分子指纹”,开启MRD检测2.0时代】
文章图片
朗微?:个体化MRD检测 , 定制每位患者“分子指纹”
随着肿瘤精准诊疗的普及 , MRD已成为临床关注的重点之一 。 MRD是指癌症根治性治疗后残留在体内的少量癌细胞或来源于癌细胞的分子标志物 。 目前 , 国际主流MRD检测主要包含了两种不同的策略:基于固定panel的方案 , 以及基于肿瘤检出突变信息定制panel的个体化方案 。
固定panel的现成解决方案以驱动基因和靶向药物基因为设计思路 , 通常需要100 kb或更大以达到更好的位点覆盖 , 如果提高测序深度将大幅增加检测成本 , 且仅能覆盖少数几个患者特异的变异位点 , 故而其检测敏感性可能会受限;
个体化定制方案结合患者肿瘤组织的全基因组测序结果 , 定制专属MRD检测方案 , 覆盖变异更广更精准 , 测序深度可以极限提升到100,000x以上 , 有效确保MRD检测的敏感性和准确性 , 更有利于进行全程监控 。
燃石医学实体瘤MRD检测产品——朗微? , 将根据每一位实体瘤患者基因变异图谱定制个体化MRD检测方案 , 用于实体瘤患者的预后评估、复发风险分层、动态复发监测等 , 助力患者肿瘤治疗全病程精准管理 , 提高患者的生存获益 。
文章图片
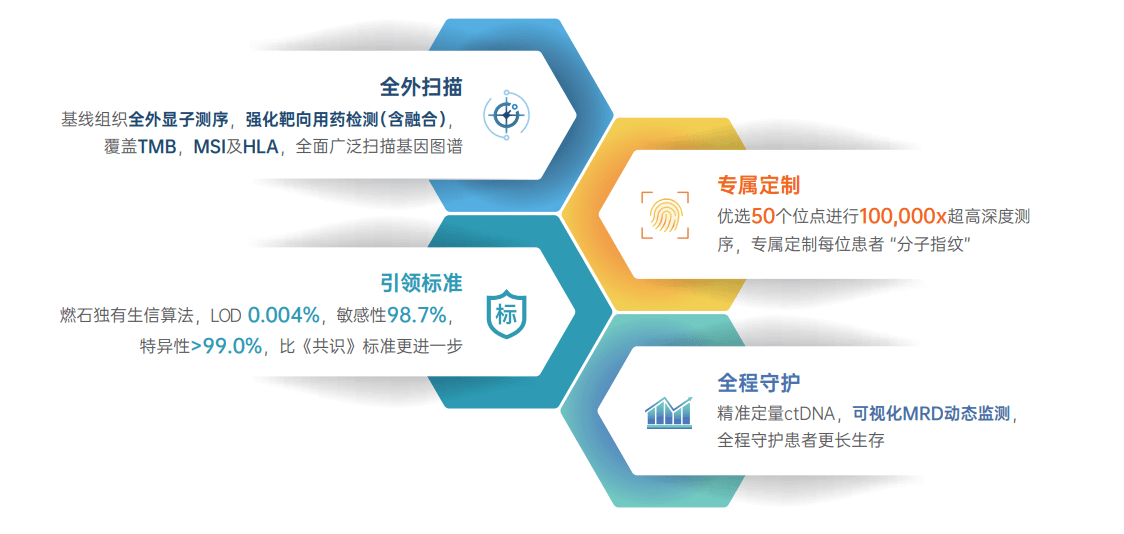
四大优势护航 , 开启MRD检测2.0时代
文章图片
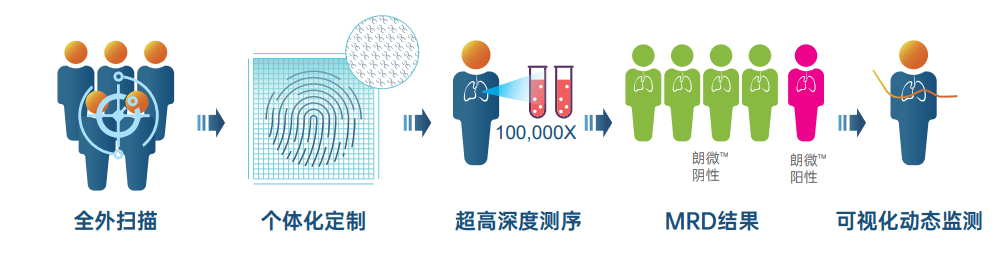
全外扫描:全外显子测序 , 全面广泛扫描基因图谱
朗微?采用基线组织全外显子测序 , 一次检测人类基因组约2万个编码基因的全外显子编码区域 , 全面精准定义肿瘤基线突变信息 , 最大化保障变异信息的检出 。
靶点增强:选用高特异性的捕获探针 , 对肿瘤用药相关基因区域增强设计 , 重点检测21个肿瘤相关融合基因的热点内含子区域 , 精准指导靶向治疗 。
免疫指导:通过金标准WES方法报告TMB信息 , 同步报告MSI、HLA分型等免疫信息 , 帮助免疫用药指导 。
专属定制:优选50个位点100,000x超高深度测序 , 专属定制每位患者“分子指纹”
朗微?采用个体化定制方案 , 结合基线全外显子测序结果 , 优选50个位点进行100,000x超高深度测序 , 在保障检测广度的同时兼顾检测深度 , 精确定位基因变异 , 精准选择监控位点 , 个体化定制专属“分子指纹” 。
引领标准:触碰十万分位的灵敏度
在实际应用中 , 由于实体瘤早期释放到外周血中的ctDNA(循环肿瘤DNA)含量非常微量 , 并伴随着克隆性造血等挑战 , 因此实体瘤MRD检测对技术的要求更高 , 需要具备更高的检测敏感性 。
朗微?使用燃石独创生信算法 , 可以稳定检出丰度低至0.004%的ctDNA , 突破MRD共识的检测技术要求(《非小细胞肺癌分子残留病灶专家共识》[1]规定MRD检测基本技术标准是可稳定检测出丰度≥0.02%的ctDNA) 。 在准确检出超低频变异的同时 , 检测敏感性可达98.7% , 特异性超过99.0% , 为患者带来更精准的检测结果 。
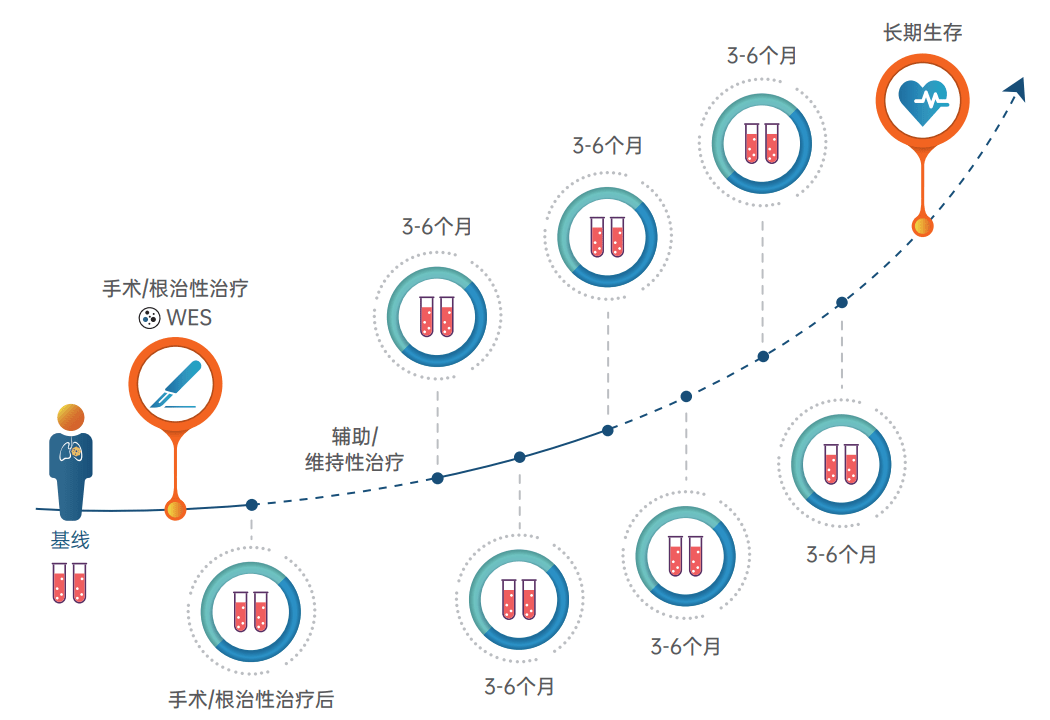
全程守护:全程动态监测 , 守护实体瘤患者实现更长生存
朗微? 基于专属MRD检测方案对实体瘤患者的样本进行多时间点、超高灵敏度的可视化动态监测 , 更准确判断患者MRD状态 , 帮助患者精准预测预后 , 提早发现疾病复发 , 实现全病程管理 。
文章图片
多项临床验证表明朗微?显著提升MRD临床检测性能
截至目前 , 燃石医学与众多临床专家在肺癌、肠癌、胃癌等多个实体瘤中开展多项临床研究 , 充分验证了朗微?能显著提升MRD临床检测性能 , 并具有精准预测预后、提前预测复发等临床价值 。
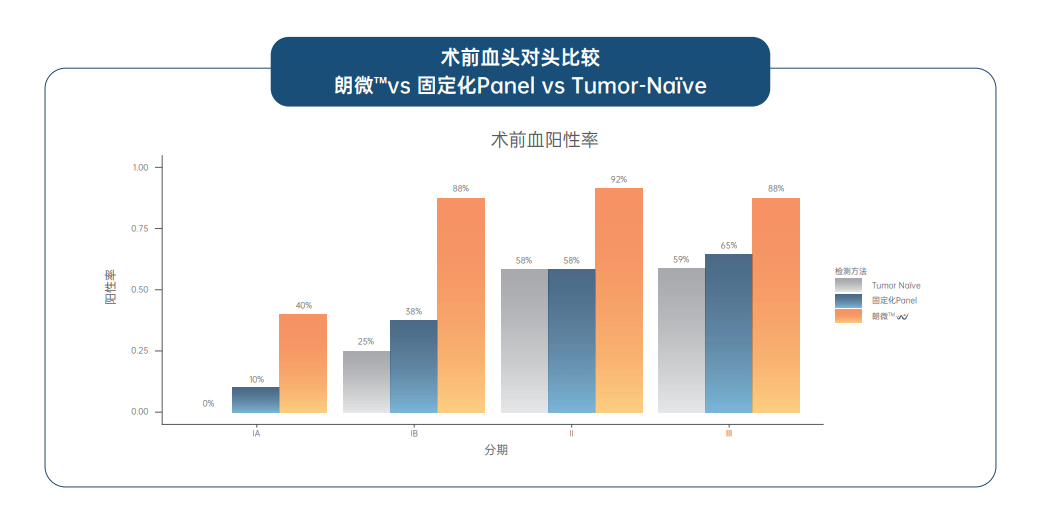
一项纳入53例I-III期肺癌患者的临床研究表明 , 朗微?相比于固定panel的tumor na?ve(不依赖肿瘤组织检测的信息 , 直接进行分析)或tumor informed(依赖肿瘤组织检测的信息)方法在术前能显著提升ctDNA检出率 , 表现出更高的检测敏感性 , 同时朗微?对术后血MRD状态的评估展现出了最佳的预后预测价值 。
文章图片
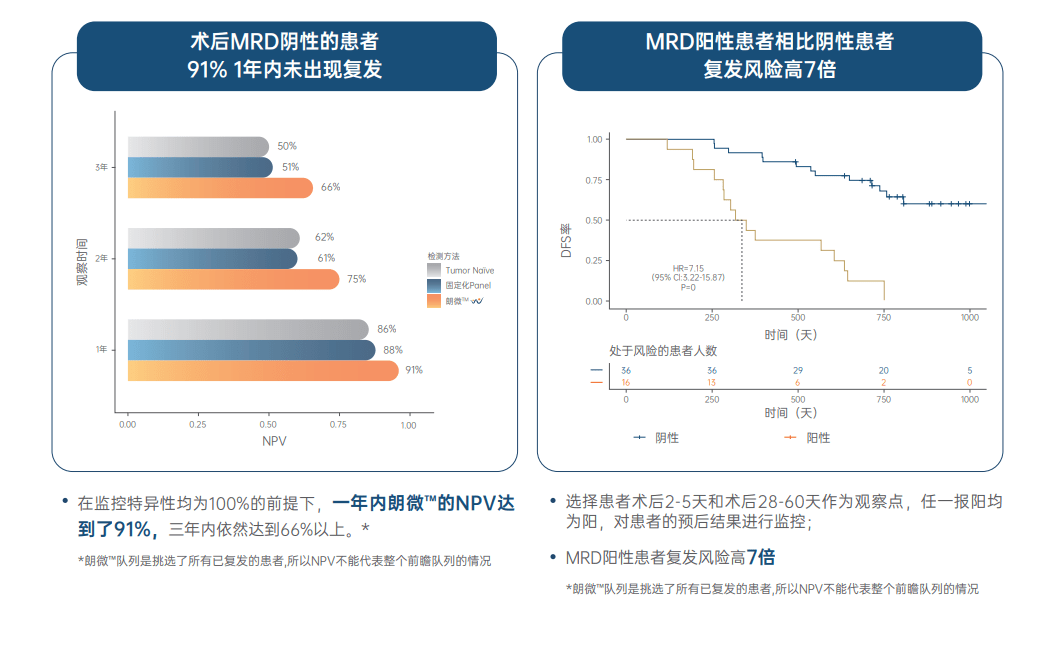
文章图片
一项纳入42例I-III期结直肠癌患者的方法学头对头比较显示 , 朗微?检测的术前血阳性率(95%)显著高于tumor na?ve方法(69%) , 且朗微?检出MRD阳性患者复发风险显著高于阴性患者 。
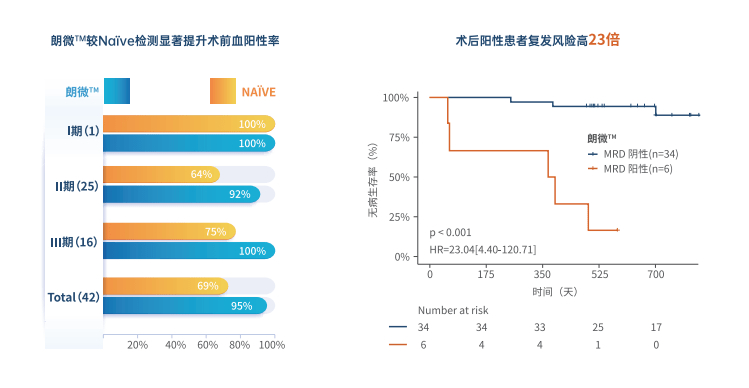
文章图片
拓展阅读:MRD检测——预后评估和复发监控的利器
多个临床重磅研究表明 , 基于血液ctDNA技术的MRD检测和动态监测 , 在多种实体瘤中展现出了良好的预后价值 。
在肺癌、结直肠癌、乳腺癌、胃癌等大量实体瘤中的研究发现 , 肿瘤患者术后MRD与复发风险强烈相关 , 相比于MRD阴性的患者 , MRD阳性的患者复发风险显著升高 , 而且这种预测价值独立于临床病理高危因素[2-7] 。
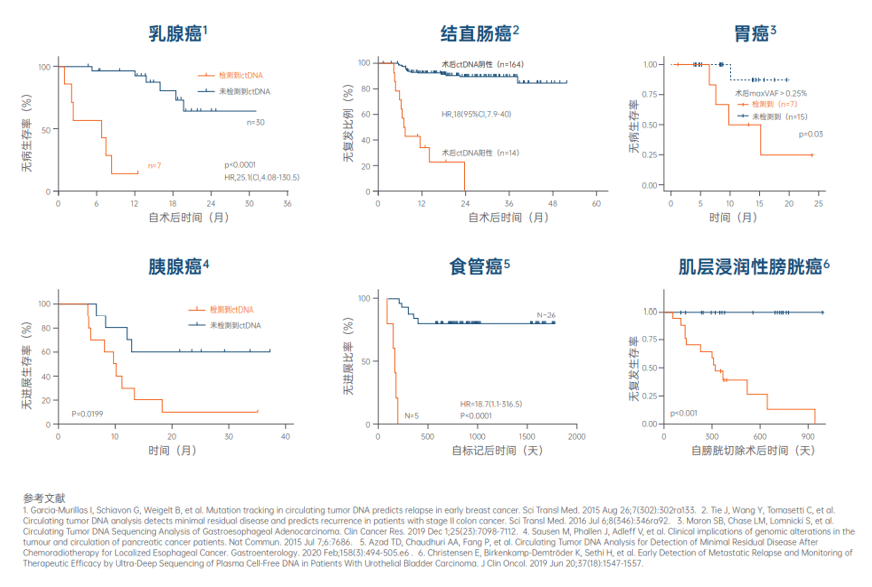
文章图片
MRD在多个实体瘤中的临床价值得到证实
同时 , 基于ctDNA的MRD检测可以比传统临床或影像学方法更早地捕捉到肿瘤分子异常信号 , 提前预警复发 , 在临床上具有重要的意义 。 比如:
CAPP-seq研究[8]发现 , 72%患者中监测到的ctDNA阳性早于影像学进展 , 平均时间提前5.2个月;
TRACERx研究[9,10]表明MRD在肺癌中的预后预测和复发预警价值 。 该研究在2017年和2020年分别发布的结果分别显示 , MRD阳性前置预警时间70天;MRD阳性前置预警率及中位预警时间:Shedders(基线ctDNA阳性) , 91%(38/42) , 164天 , Non-shedders(基线ctDNA阴性) , 64%(7/11) , 22天 。
此外 , MRD检测结果可有效指导临床治疗方案的调整 。 目前局部晚期不可切除的非小细胞肺癌患者 , 根治性放化疗(CRT)后免疫检查点抑制剂(ICI)巩固治疗是标准方案 , 研究发现:患者经过CRT后 , 若通过监控发现 ctDNA阳性(即MRD阳性) , 更应接受 ICI 巩固治疗;CRT 后若ctDNA阴性(MRD阴性) , 则可能无法从 ICI巩固治疗中获益[11] 。 上述研究为回顾性分析 , 尚待更大样本量的前瞻性研究证实 。
MRD阳性的患者或可考虑升阶的辅助治疗 , 降低疾病复发风险;MRD阴性的患者 , 可考虑降阶的辅助治疗 , 降低治疗毒性[12,13] 。 国内外已有多项基于 MRD 的前瞻性干预性升/降阶梯治疗的临床研究正在开展 。
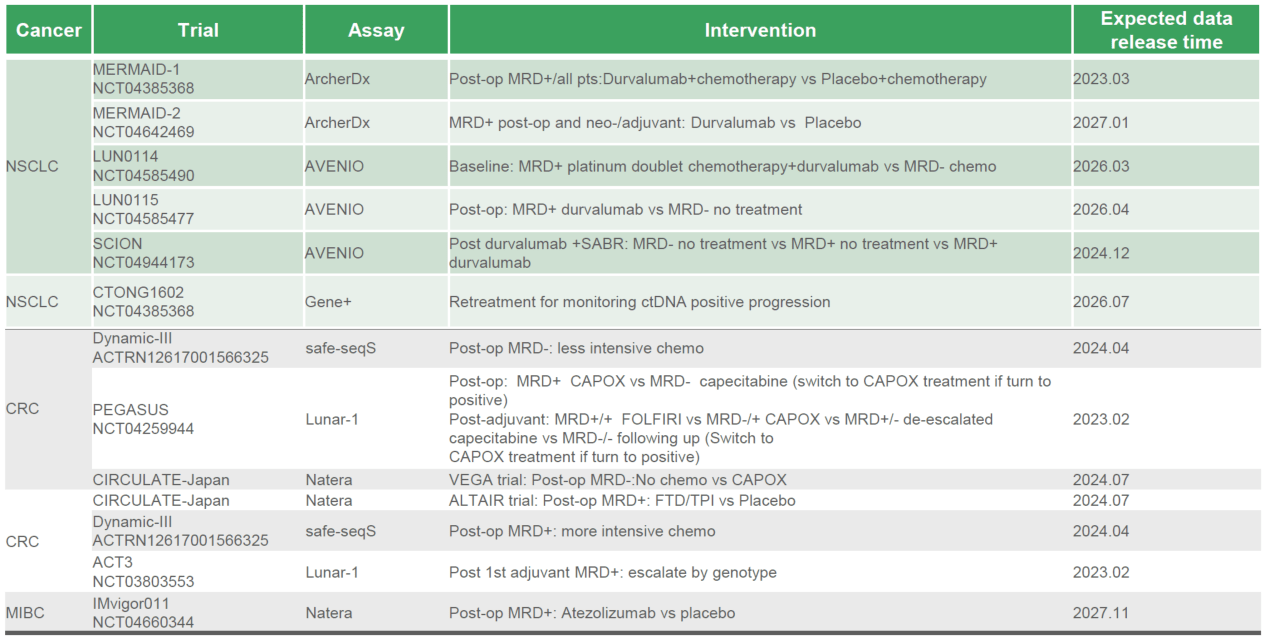
文章图片
MRD前瞻性干预性升/降阶梯治疗的部分临床研究
目前 , 已有多个行业共识肯定了基于ctDNA的MRD检测对肿瘤患者术后精准诊疗的应用价值 , MRD检测正大步迈入临床应用 。

文章图片
多个肿瘤指南/共识推荐采用ctDNA进行MRD检测
本次燃石医学朗微?的上市将为实体瘤患者术后复发风险评估、预后预测、用药治疗指导和全病程管理提供全新的、定制化的解决方案 , 精准检测赋能临床诊疗 , 期待MRD检测2.0时代的到来!
参考文献
[1]吴一龙, 陆舜, 程颖, 等. 非小细胞肺癌分子残留病灶专家共识. 循证医学, 2021,21(3): 129-135.
[2] Sci Transl Med. 2015 Aug 26;7(302):302ra133.
[3] Sci Transl Med. 2016 Jul 6;8(346):346ra92.
[4] Clin Cancer Res. 2019 Dec 1;25(23):7098-7112.
[5] Nat Commun. 2015 Jul 7;6:7686.
[6] Gastroenterology. 2020 Feb;158(3):494-505.e6 .
[7] J Clin Oncol. 2019 Jun 20;37(18):1547-1557.
[8] Cancer Discov. 2017 Dec; 7(12):1394-1403.
[9] Nature. 2017 Apr 26;545(7655):446-451.
[10] Chris Abbosh et al. AACR 2020
[11] Nat Cancer. 2020 Feb;1(2):176-183.
[12] 2021 ESMO Abstract 3716
[13] Cancer Sci. 2021 Jul;112(7):2915 2920.
推荐阅读
- 人物|英国女王新冠确诊新冠一周后康复 与家人共度愉快的下午
- 的材料|全球量子点传感器市场规模2027年将达3.28亿美元
- 技术|【比特熊故事汇】2月MVP英雄故事|有爱的开源
- 人物|涉24亿美元加密货币骗局,BitConnect创始人失踪
- 苹果|苹果头戴式显示器专利获授权
- 检测|化学战!可以考虑请苍蝇帮帮忙
- 企业需求|直播送“饭碗” 工作触屏可及
- 员工|[原]前大厂员工谈中美企业区别,中企不用单元测试,仅靠QA检查代码?
- 上市|传奇生物CAR-T获FDA批准上市
- 东洋|开展实习实训 培养技术人才







