多发性骨髓瘤的双特异性抗体疗法Tecvayli获欧盟批准!
【多发性骨髓瘤的双特异性抗体疗法Tecvayli获欧盟批准!】2022年8月25日 , 欧盟委员会(EC)批准了BCMA/CD3双特异性抗体Tecvayli(Teclistamab)有条件上市 , 适应症为单药治疗复发/难治性多发性骨髓瘤(RRMM)成人患者 。 这些患者接受过至少三种前期疗法 , 包括免疫调节剂 , 蛋白酶体抑制剂和抗CD38抗体 , 并且疾病仍然出现进展 。
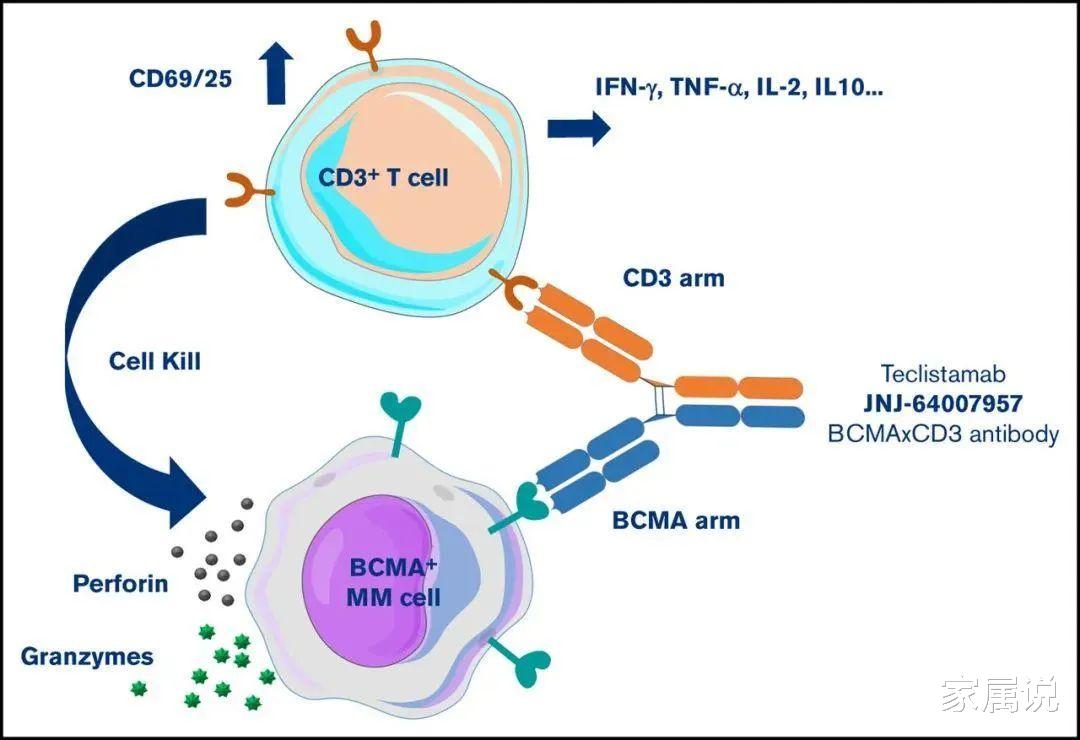
Teclistamab是通过将CD3阳性T细胞募集到表达BCMA的骨髓瘤细胞附近 , 激发T细胞杀伤肿瘤细胞的“first-in-class”双特异性抗体疗法 。 B细胞成熟抗原(BCMA)是一种肿瘤坏死因子(TNF)受体超家族成员的膜蛋白 , 在多发性骨髓瘤(MM)细胞上广泛表达 , 而在正常细胞中几乎没有表达 。 因此 , 通过BCMA/CD3双抗 , 能够有效地将T细胞“募集”至这一靶病灶区域 , 并激活T细胞 , 杀死存在BCMA高表达的癌细胞 。
图注:Teclistamab作用机制
值得一提的是 , Teclistamab是首款获批治疗多发性骨髓瘤的双特异性疗法 , 也是首款获批靶向BCMA的双特异性抗体 。
商品名:Tecvayli
通用名:Teclistamab
代号:JNJ-64007957
靶点:BCMA/CD3
美国首次获批:尚未获批
中国首次获批:尚未获批
欧盟获批适应症:复发/难治性多发性骨髓瘤
临床数据此次批准是基于开放标签I/II期临床试验MajesTEC-1的积极结果的支持 。 该试验评估了Teclistamab在复发/难治性多发性骨髓瘤成人患者中的安全性和有效性 。
试验的主要终点是独立审查委员会评估的客观缓解率(ORR) 。 关键的次要终点包括反应持续时间(DOR)、很好的部分缓解或更好缓解(VGPR)、完全缓解(CR)、无进展生存期(PFS)和总生存期(OS) 。 其他次要终点包括最小残留疾病状态、安全性、药代动力学和免疫原性 。
在该试验中 , 共纳入164例患者 , 入组患者每周一次皮下注射Teclistamab , 剂量为1.5 mg/kg , 然后逐步增加到0.06 mg/kg、0.3 mg/kg的剂量 。
总体人群特征包括:中位年龄为64.0岁 , 58.2%的患者为男性 , 81.2%的患者为白人 , 66.7%的患者ECOG评分至少为1 , 52.5%的患者为I期疾病 , 既往接受中位治疗线数为5 , 全都接受过3线治疗 。 此外 , 92.1%的患者对免疫调节药物出现耐药 , 86.1%的患者对蛋白酶体抑制剂耐药 , 89.7%的患者对CD38单克隆抗体耐药;77.6%的患者为三类难治性患者 , 30.3%为五药难治性患者 , 89.7%患者对他们接受的最后一条治疗无效 。
试验结果显示 , 在中位随访时间为14.1个月时 , 总客观缓解率(ORR)达到63% , 值得注意的是 , 58.8%的患者获得很好的部分缓解或更好缓解(VGPR) , 39.4%的患者达到完全缓解(CR)或更好缓解 。
其他数据显示 , 首次反应的中位时间为1.2个月 , 达到最佳反应的中位时间为3.8个月 。 此外 , 26.7%的患者为微小残留病灶(MRD)阴性 , 46%达到CR或更好缓解的患者没有MRD 。 髓外疾病、III期疾病和浆细胞骨髓置换患者的缓解率降低了至少60% , 但接受不超过3线治疗的患者缓解率更高 。
中位持续缓解时间(DOR)为18.4个月 , 中位无进展生存期(PFS)为11.3个月 , 中位总生存期(OS)为18.3个月 。
不良反应Teclistamab最常见的任何级别不良反应包括:细胞因子释放综合征(72%)、中性粒细胞减少症(71%)、贫血(55%)、上呼吸道感染(37%)和肺炎(28%) 。
最常见的3或4级不良反应包括:中性粒细胞减少症(64%)、贫血(37%)、肺炎(19%)、上呼吸道感染(2.4%)、肺炎(19%)和细胞因子释放综合征(0.6%) 。
此外 , 75%的患者出现低丙种球蛋白血症 , 39%的患者接受了免疫球蛋白治疗 。
小结Teclistamab的此次批准标志着在复发和难治性多发性骨髓瘤患者中取得了重大进展 , 并为这类患者提供了一个新治疗选择 。 此外 , 也解决了多发性骨髓瘤患者的免疫调节剂、蛋白酶体抑制剂和抗CD38单克隆抗体等药物难治性的问题 。
参考来源:
https://www.onclive.com
【重要提示】所有文章信息仅供参考 , 具体治疗谨遵医嘱!
推荐阅读
- 睿昂基因淋巴瘤试剂盒预计一年内完成临床注册研究
- 黑猩猩腺病毒+自扩增mRNA癌症疫苗,延长晚期实体瘤患者总生存期
- 百趣代谢组学资讯: 项目文章Nature,揭示低温暴露抑制实体瘤生长机制,‘饿死’癌细胞
- 肿瘤基因检测
- 火箭放弃毒瘤!斯通欲用波特和马丁交易魔术萨格斯和开拓者利特尔
- 质谱盛会!组学与质谱技术相互融合,共同助力肿瘤早筛早诊
- Science|周荣斌、江维、唐任宏发现介导肿瘤免疫抑制的神经内分泌通路和免疫治疗新靶点
- 脐带血CAR-NK细胞疗法或成肿瘤免疫治疗新利器
- 两年半亏掉5.66亿元,真实生物要上市了!阿兹夫定还能治疗血液肿瘤?
- 放弃欧文、希尔德!湖人新赛季再添毒瘤,首轮签换“年轻版”威少





