【回输到体内的干细胞最后去了哪?】

文章图片
文章图片
文章图片
在临床研究或者临床治疗中 , 常常有回输干细胞的案例 。 有很多朋友 , 一边支持干细胞这项尖端生物科技 , 一边也会怀疑 。
“无论我身体哪里有毛病 , 是肝脏、关节、还是卵巢 , 为什么每次都是静脉回输干细胞?
通过静脉进入我身体的干细胞最后去了哪儿?在哪里“安家”呢?“安家”之后又是怎样发挥疾病治疗的作用?”
无论是“骨髓移植”(造血干细胞移植) , 还是静脉回输间充质干细胞 , 干细胞在体内都需要运输 , 需要被调动到受伤的组织周围发挥功能 。
因此 , 干细胞需要一个帮它导航定位的“GPS” , 而这种能力就是干细胞的“归巢性” 。
1、自带“GPS” , 哪缺补哪
干细胞归巢就是指自体或外源性干细胞在多种因素的作用下 , 能定向趋向性迁移 , 越过血管内皮细胞至目标组织 , 并定植存活的过程 , 类似于人体局部炎症反应后大量白细胞迁移至炎症周围 。
简单来说 , 当机体遭受损伤时 , 干细胞会自发去向损伤部位 , 这就好比干细胞身上装上了一个GPS , 能无时无刻的指引它到达目的地——机体损伤后需要修复的部位 。 这种特性是干细胞安全用于临床的关键 。
那么 , 如果身体有多处炎症 , 回输至体内的干细胞又是如何分配归巢的呢?
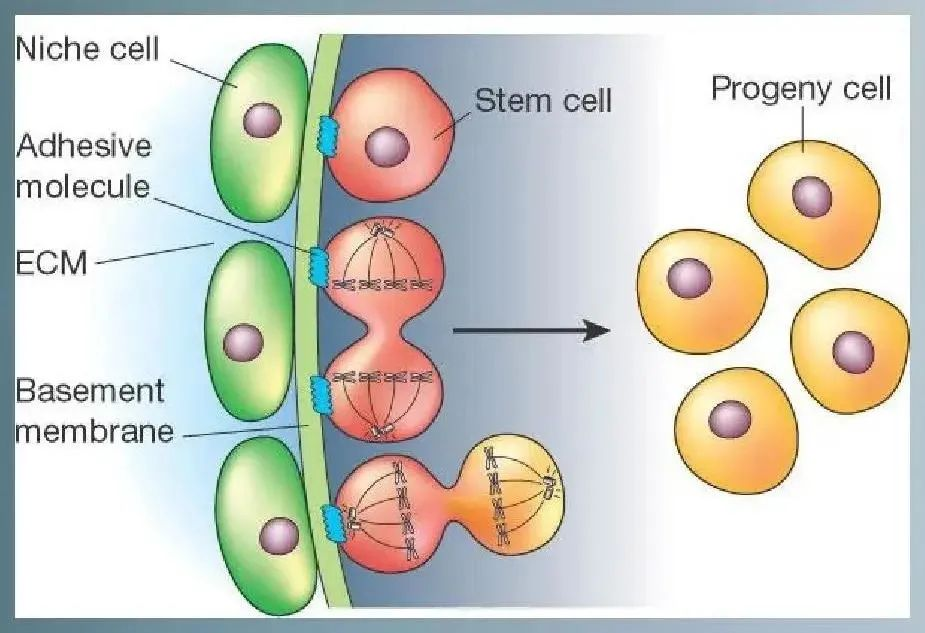
干细胞周围的细胞形成像摇篮样的环境保护着干细胞 , 这一环境被称为微环境(Niche) 。 微环境由和干细胞相邻的各种细胞、细胞外基质(ECM)以及多种细胞因子等构成 。 微环境不仅给干细胞提供养分 , 同时还指导干细胞的行动 , 决定干细胞的分化方向 。
微环境改变是干细胞归巢的始动因素 , 组织损伤局部表达多种趋化因子、黏附因子、生长因子等各种信号分子 。 不同的微环境分泌不同的信号分子 , 吸引干细胞定向到达该组织 。 干细胞归巢 , 最终归巢至骨髓 , 归巢至各个脏器 , 归巢至炎症及创伤部位 , 甚至归巢至肿瘤部位 。
2、提高归巢效率 , 效果最大化
干细胞的归巢性对其在临床上的疗效起到至关重要的作用 , 然而常常遇到干细胞归巢效率低下的问题 , 近年来科学家们对此展开了大量的研究 , 以提高归巢率实现提高疗效与减少副作用 。 为了提高干细胞的归巢效率 , 科学家提出了几种方法 。
1.基因改造 , 可通过病毒转导使干细胞表达归巢因子 。 如趋化因子(CXCR4)或粘附受体(VLA-4)等 , 从而使得干细胞归巢效率提升 。 发表于《Stroke》的一篇文章显示 , 对大鼠间充质干细胞进行基因修饰后 , 使其过表达整合素α4 , 可促进干细胞向颈动脉注射后的脑栓塞部位迁移 。
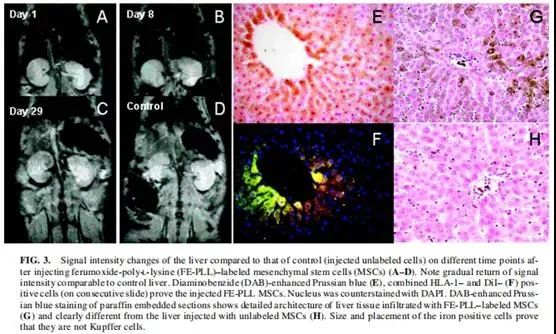
2.磁引导技术 , 科学家还想到利用磁场引导干细胞到达特定损伤部位 , 用磁性颗粒标记的干细胞利用外部磁场被引导到损伤部位 。 用氧化铁(Fe2O3)颗粒标记间充质干细胞静脉注射大鼠 , 以是否在肝脏上方放置外部磁铁的大鼠分为试验组和对照组 。 戴上外磁铁的大鼠在给药15天后肝脏中标记的干细胞数量大约是对照组的2倍 。 在没有戴磁铁的大鼠中 , MSCs主要分布在门脉系统周围 , 但在戴磁铁的大鼠中 , MSCs渗透到更深的肝实质中 。
3.水凝胶支架 , 科学家还尝试将趋化因子或细胞因子浸渍的水凝胶支架植入靶组织来调节干细胞归巢;直接将干细胞注射至靶组织;减少肺内血管干细胞滞留等方法来提高干细胞的归巢性 。
在疾病治疗研究中 , 目前通常采用动脉介入、静脉输注、局部注射移植等方式进行干细胞移植 , 然后依靠其归巢特性可以快速到达损伤部位 , 参与损伤修复和更替 。
归巢性是干细胞能够应用于疾病治疗 , 特别是全身系统性疾病治疗的重要机制之一 。 也正是因为这个原因 , 干细胞在临床上具有巨大的应用潜能 。
推荐阅读
- 宇宙奥秘:能量既然不能凭空产生,那生成宇宙的能量来自哪里
- 探索宇宙:宇宙中也有“长城”?科学家发现罕见天象,它距离地球仅5亿光年
- 肥皂泡破裂时温度达2万℃,高过太阳温度,为何不烫?
- 距地7亿公里外,NASA的探测器,发现了一个神奇的冰下世界
- 为何科学家怀疑外星人在“操纵”地球?已发现太阳系3处“异常”
- 黑洞:生于时间之始,可解暗物质之谜
- 火星的一个特定区域可能在几十亿年里多次孕育了生命
- 全球至今无法解释的神秘事件,你知道哪些?最后一个你经历过吗?
- 地球是个生命体?科学家曾发现地球微微颤动,5小时震十多次!




