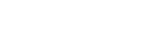介 绍
华粤企业集团旗下艾贝泰生物技术有限公司 细胞医学部 根据细胞存储、细胞治疗技术研发、应用研究等不同领域的特点 , 推出针对性应用技术的 细胞治疗平台 产品链 。
自 2009 年 , 荷兰科学家 Hans Clevers 实验室首次在体外将 Lgr5+ 肠道干细胞培养成小肠类器官 , 短短十几年 , 类器官(Organoid)火爆科研圈 , 成为炙手可热的体外模型系统 。
类器官是体外培育的 3D 迷你器官 , 能高度模拟体内组织器官的结构和功能 , 来源于组织或胚胎干细胞(ESCs)/诱导多能干细胞(iPSCs) 。 作为体外模型系统 , 类器官可用于解析遗传发育、建立疾病模型、筛选药物和检测毒性以及探索个性化医疗方案 。 目前 , 已成功培育出脑、结肠、内耳、小肠、肾脏、肝、肺、胰腺等不同器官的类器官 , 其培养条件及方法各不相同 。
CRISPR–HOT基因编辑方法的建立
CRISPR-Cas9等基因编辑工具在消除疾病和遗传疾病方面具有巨大的应用潜力 。 将突变基因替换为正常基因有可能成为未来医生治疗患者的重要手段 。 类器官是可以在实验室中生长的微型器官 。 目前 , 类器官在生命科学研究中应用广泛 , 其在发育生物学、病理学、细胞生物学、精准医疗以及药物毒性和药效试验等领域都有着巨大的应用潜力 。 通过改变不同类器官的基因可以极大地帮助研究生物学过程和疾病建模 。 然而 , 由于缺乏简单的基因组工程方法 , 基因组编辑人类类器官的构建比较困难 。
在2020年3份 , 荷兰Hubrecht Institute的Hans Clevers研究组在Nature Cell Biology杂志上发表文章Fast and efficient generation of knock-in human organoids using homology-independent CRISPR–Cas9 precision genome editing , 利用非同源依赖的CRISR-Cas9技术快速高效地对人源类器官进行基因敲入 , 作者们将该技术命名为CRISPR–HOT【CRISPR-Cas9-mediated homology-independent organoid transgenesis】 , 为人源类器官的内源基因敲入提供了重要的工具平台 。 该方法可标记人类类器官中的特定基因 , 简化了类器官的基因组编辑过程 , 为类器官可视化研究提供了可靠的基因编辑方式 。 研究人员利用这种新方法分析了肝细胞如何分裂以及DNA过多异常肝细胞是如何出现的 , 并发现敲除癌症基因TP53 , 异常肝细胞的非结构化分裂会更频繁 。 以上发现或有助于深入研究相关癌症的发展过程 。
文章图片
图示1:HDR与NHEJ的技术路线以及优劣比较
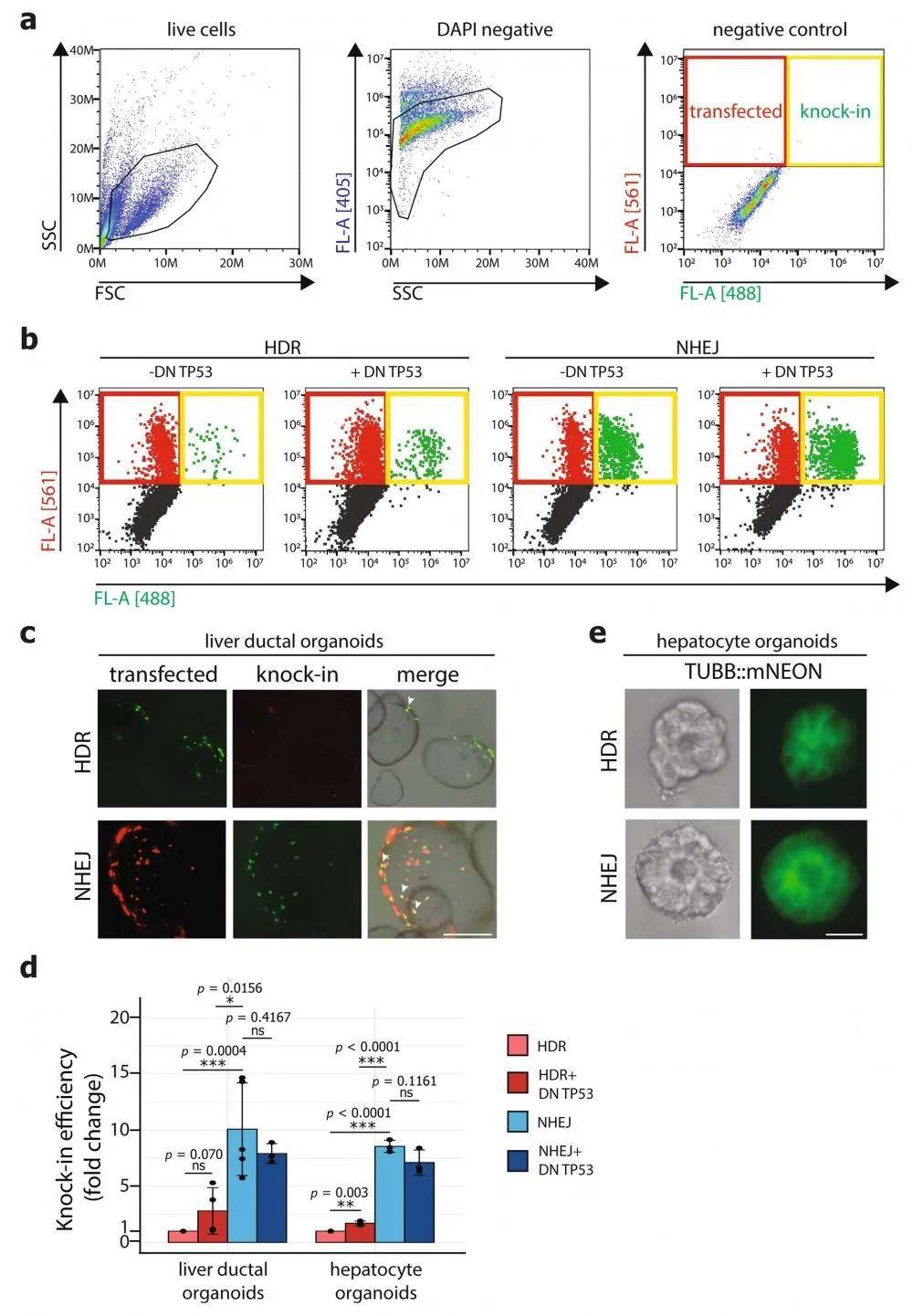
研究者们为了印证CRISPR–HOT技术在人源类器官中进行基因敲入的方法可行 , 首先在两种难以转染的人源类器官(肝脏导管类器官及肝细胞类器官)进行测试 , 并对两种不同介导方式的基因敲入技术产生的类器官进行对比分析 。
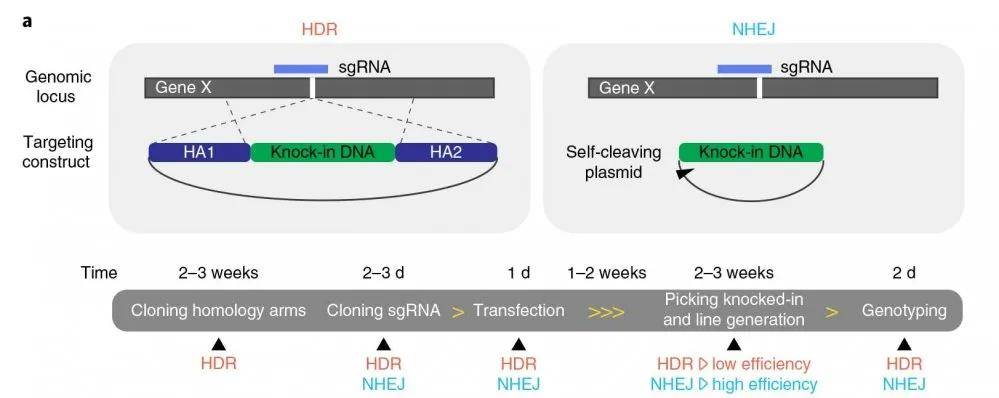
结果显示:以KRT19基因为靶点 , 采用NEPA21 高效基因转染系统进行转染 ,转染5天后 , 观察了HDR条件下的一些敲入细胞 , 通过荧光激活细胞分选(FACS)分析了转染的敲入细胞(HDR和NHEJ 实验的转染效率均在0.2%~0.7%之间) 。 相比之下 , 研究者发现在检测NHEJ介导的基因插入时 , 敲入细胞明显增多(图1b , 补充数据图2a-c) 。
文章图片
图示流式细胞仪检测
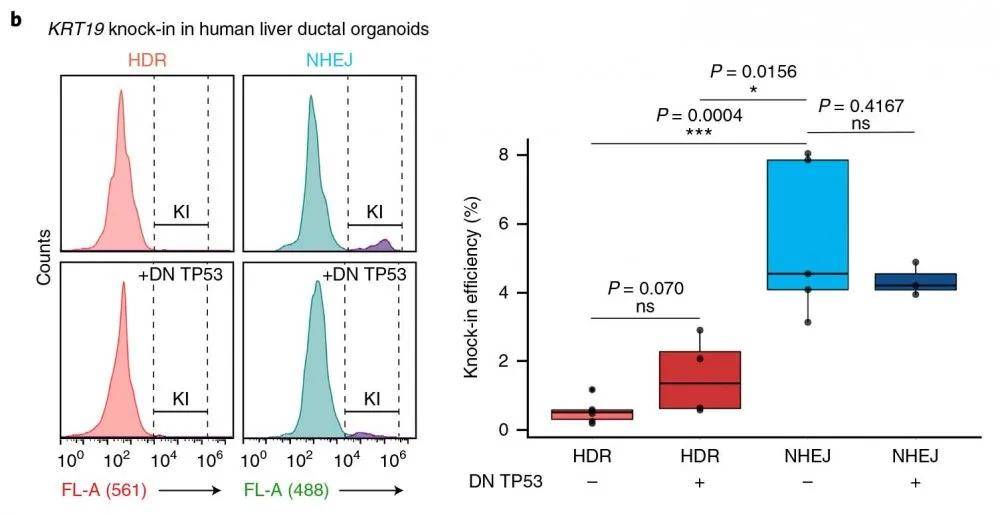
以TUBB基因为靶点 , 采用NEPA21 基因高效转染系统进行细胞转染转染 , 再次观察到 , 与HDR介导的敲入相比 , 在转染的人群中 , NHEJ的效率显著提高(转染效率在9%~14%之间;图1c , 补充数据图2a , b)
文章图片
流式细胞仪检测
补充数据图2如下:
文章图片
文章图片
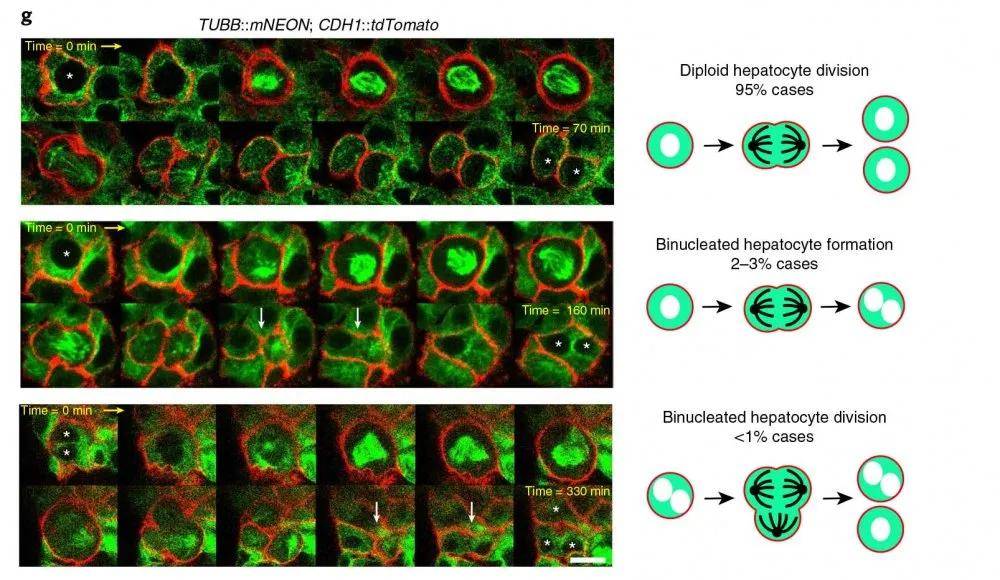
图示 双报告基因肝细胞类器官中肝细胞分裂的不同方式
总的来说 , Hans Clevers研究组的工作用CRISPR-HOT方法 , 建立了不依赖于对TP53活性抑制的以NHEJ介导的基因编辑技术 , 简化了基因敲入的流程 , 对于肝细胞等成体干细胞来源的类器官可视化研究提供了可靠的基因编辑方式 。 虽然抑制TP53的活性之后 , HDR介导的基因敲入方式的效率略有提高 , 但仍然比NHEJ介导的基因编辑效率要低 , 研究人员相信CRISPR-HOT可以应用于许多类型的人体器官 , 可视化任何基因或细胞类型 , 对今后研究生物过程和疾病模型的建立有很大的帮助 。
在文章整个实验流程的重要步骤---转染流程当中 , 收获到了一把助力研究者们实验的“利器”——NEPA21 , NEPA GENE 。

文章图片
文章图片
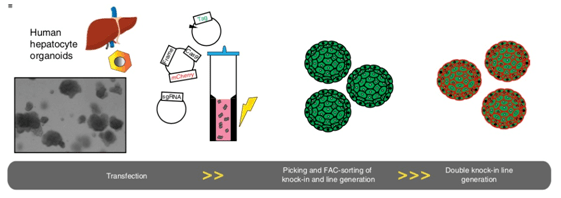
人类肝细胞的转染和敲入过程 。 类器官被分解成小的细胞团与质粒DNA混合 , 在电极杯中进行电穿孔 。 单个转染后的细胞生长为类细胞体 , 挑取建立克隆系 。
随后 , 在2020年11月 , Hansclever在Nature Protocols 杂志上发表的”Establishment of human fetal hepatocyteorganoids and CRISPR–Cas9-based geneknockin and knockout in organoid cultures fromhuman liver”,又使用了CRISPR HOT的方法对人类肝细胞来器官进行基因编辑 。
一直以来 , 人类原代肝脏细胞难以扩增培养 , 此文章中 , 作者详细列出了如何克服种种局限 , 建立了有助于人类胎儿肝细胞作为类器官的长期扩增的培养条件 。 此外 , 文章也介绍了如何在人类胎儿肝细胞和成人肝导管类器官系统中使用CRISPR–Cas9产生(多)基因敲除 。 使用CRISPR–Cas9和不依赖同源性的类器官转基因(CRISPR HOT)方法 , 可以在这些系统中实现有效的基因敲入 。 这些基因敲除可用于多种应用 , 例如疾病建模 , 研究基因功能和研究过程(例如细胞分化和细胞分裂) 。
文章图片
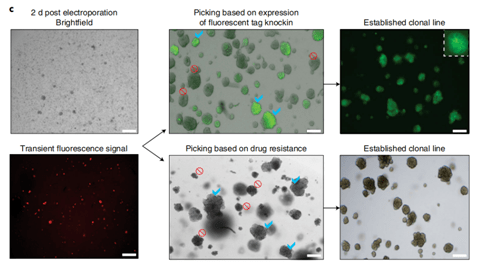
图示3:人类胎儿肝细胞类器官的基因组工程技术概略图
文章中 ,针对人类胎儿肝细胞和人类肝导管类器官的基因组编辑需要两种不同的实验程序(图3和4) 。 对于人类胎儿肝细胞类器官 , 采用基于比色皿电穿孔的转染策略。 为此 , 类器官必须分解成单细胞或小块细胞 , 建议从第5代及以后开始对肝细胞类器官系进行基因组工程设计 , 肝细胞类器官电穿孔的能力通常不会随时间而降低 , 作者已经成功地对人胎儿肝细胞类器官进行了基因组工程 , 可以做到至少第50代为止 ,相反 , 对于人肝导管类器官 , 转染步骤是对完整的类器官进行的 , 是一种离体组织电转染的方式。两种电转染方式均采用的NEPA21基因高效转染系统完成。 另外针对不同的编辑方式(Knock in和Knock out) , 作者也分享了非常详细的应对策略(见下图) 。 利用NEPA21在Hans Clever实验室所做的研究中也都得到了很高的编辑效率 。
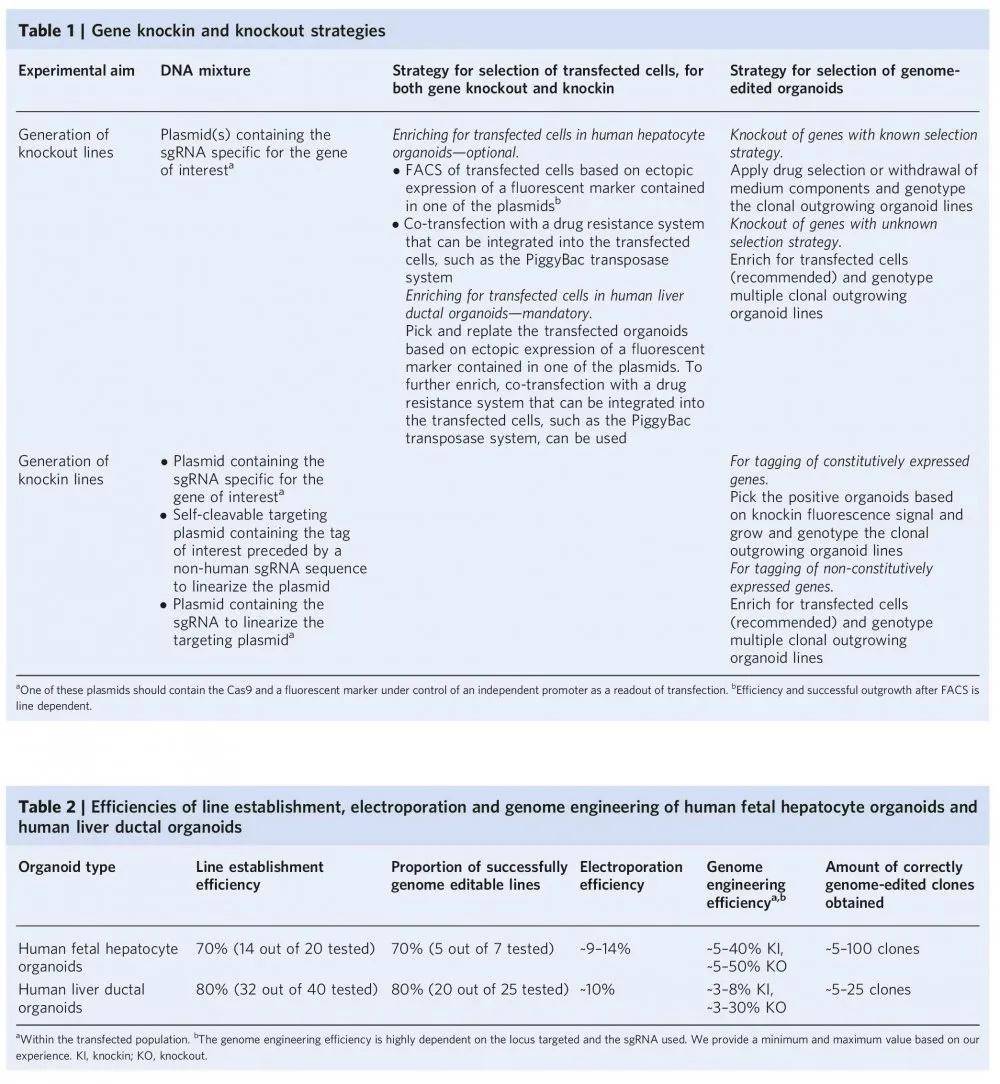
文章图片
除此之外 , 在2020年2月份时 , Hans Clevers研究组在Cell Stem Cell发表文献 , 题为CRISPR-based adenine editors correct nonsense mutations in a cystic fibrosis organoid biobank, 利用CRISPR依赖的单碱基编辑技术 , 以囊性纤维化疾病 (Cystic Fibrosis) 病人样品建立起的类器官为样本 , 对致病基因CFTR (CF transmembrane conductance regulator gene) 中的突变进行编辑和修复 , 为临床上囊性纤维化疾病尤其是相对罕见的突变的修复提供了可参考的治疗方案 , 同时也为体外进行大规模药物筛选并对病人进行个性化医疗方案的设计提供了重要的数据库 (见下图)。

文章图片
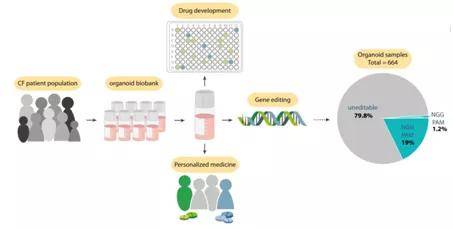
文章图片
图示 囊性纤维化病人类器官生物库的建立、药物筛选以及基因编辑修复
NEPA21 电转染仪
NEPA21 电转染仪采用全新设计的电转程序 , 特别适用于难转染细胞、离体组织或动物活体的转染 。 配合独有的电压衰减(Voltage/Decay)设计 。
NEPA21可在获得高转染效率的同时 , 提高细胞存活率 。 专门针对难转染的原代免疫细胞、干细胞、神经细胞、活体动物、受精卵及宫内胚胎等转染 , 多篇文献支持 , 是Crisper/Cas-9 基因编辑中常用电转系统!
【器官|【推荐】Crisper/Cas9在类器官领域中的应用】文章参考文献详见 艾贝泰细胞 中文章 。
推荐阅读
- 于本|豆瓣 App 安卓新版本 7.20.0 测试
- 苏宁|可循环包装规模化应用 苏宁易购绿色物流再上新台阶
- 产品|泰晶科技与紫光展锐联合实验室揭牌
- 相关|科思科技:无人机地面控制站相关设备产品开始逐步发力
- 生活|数字文旅的精彩生活
- 解决方案|【干货】反渗透设备结垢原因及解决方案
- 手机|【直播纪要】VR/MR会吹响消费电子反攻的号角吗?| 见智研究
- 技术|聚光科技旗下临床质谱仪获批医疗器械注册证
- 智能化|龙净环保:智能型物料气力输送系统的研究及应用成果通过鉴定
- 爆发|中信证券:自动驾驶渐行渐近,惯性导航刚需爆发