文章图片

文章图片
从药物设计思路上 , 核酸聚合物(NAP)和S-抗原转运抑制寡核苷酸聚合物 (STOPS), 这两种靶点的乙肝候选药物都是针对抑制乙肝病毒(HBV)蛋白输出开发的 。 NAP全球代表候选药物有Replicor公司的REP 2139和REP 2165 , STOPS代表研究药物有ALG公司的ALG-010133 。
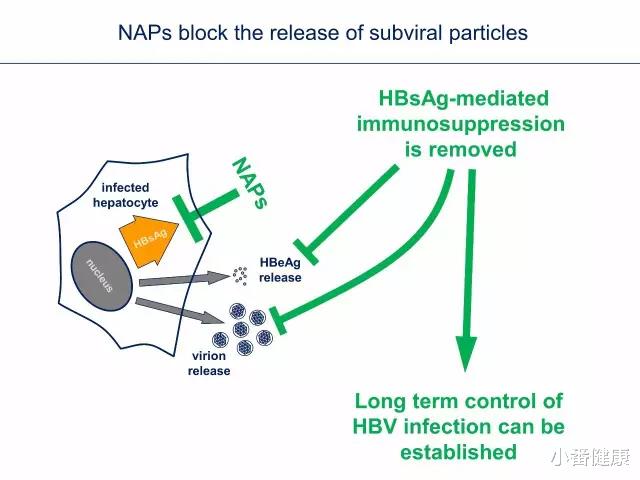
上图来源:Replicor公司乙肝药物设计者思路 , 基于抑制蛋白输出 , 细分NAP与STOPS赛道进展
因为这两种靶点研究药物都是针对抑制HBV蛋白输出 , 可以将它们归纳在一起分析其前景 。 核酸聚合物(NAP) , 可以防止乙肝表面抗原(HBsAg)亚病毒颗粒从受感染肝细胞中释放 。 既往Replicor公司研究人员曾使用人类HepG2.2.15细胞基于细胞测定研究了这种作用机制 。 在内体释放后 , NAP会通过和一些未表征的宿主蛋白相互作用 , 来破坏亚病毒颗粒的组装与分泌(但不是Dane颗粒) 。
蛋白体与溶酶体降解 , 可以防止细胞内乙肝表面抗原积累 , 而核酸聚合物可以增强这种降解作用!研究人员发现 , Dane颗粒与其他病毒标志物(例如乙肝e抗原的分泌)不受影响 , 因为它们的组装与分泌途径使通过多泡体途径 , 而不是亚病毒颗粒的内质网-高尔基中间区 (ERGIC) 途径 。
REP 2139或REP 2165都属于核酸聚合物(NAP) , 也可以称为乙肝表面抗原抑制剂 。 这两种基于(NAP-based)为基础的核酸聚合物 , 在刚刚结束的2021年欧肝会(EASL2021)中 , 也显示出抑制HBV亚病毒颗粒的分泌作用 , 从已经宣布的临床试验数据看 , REP 2139和REP 2165均表现出良好耐受性 , 在未接受治疗受试者中显示出显著活性 。 从已披露的最新进度看 , REP 2139或REP 2165依然处于II期临床阶段 。
相比核酸聚合物(NAP) , S-抗原转运抑制寡核苷酸聚合物 (STOPS) 在药物设计者眼中 , STOPS表现出更强的体外效力 , 且结构与NAP近似 。 既往ALG公司研究人员在使用细胞系模型的临床前研究中 , ALG-010133 (STOPS) 的抑制乙肝表面抗原(HBsAg)释放方向的效力是REP 2139 (NAP) 的30至180倍 。
临床前模型结果表明 , 经STOPS治疗后细胞内表面抗原水平降低 , 这说明STOPS并不是单纯地把表面抗原捕获在细胞内 , 而且STOPS没有使细胞活力受到损害 。 STOPS还显示出抗HBV泛基因型活性(A至D) , 以及100倍更理想的抑制细胞系模型中整合HBV基因组产生的乙肝表面抗原效力!
当前 , ALG-010133正在进行I期临床研究中 , EASL2021年会上 , 已经宣布了ALG-010133前两个部分试验数据 。 I期研究主要在健康受试者中 , 评估单次或多次皮下注射高达200毫克与180毫克ALG-010133 , 结果表明 , 这两种剂量下给药都具有良好安全性与耐受性 , 这项在健康受试者中的结论支持继续对随后将要进行的慢性乙肝患者中持续使用ALG-010133!(I期初步数据已发表在EASL2021) 。
小番健康结语:通过介绍核酸聚合物与S-抗原转运抑制寡核苷酸聚合物 , 可以让我们清楚地知道药物设计者是如何思考一些新机制慢性乙肝候选药物 。 以NAP与STOPS为例 , 药物设计者主要是发现 , 乙肝病毒抗原(主要指表面抗原)分泌的减少 , 将减少肝细胞上的抗原呈递 , 从原理上这种方法可以帮助慢性乙肝患者恢复耗尽的T细胞和B细胞功能 。
但是 , 随着研究进入临床阶段 , 临床工作者发现耗尽的T细胞获得了与效应T细胞不同的表观遗传特征 , 这可能无法通过单纯地减少抗原呈递来完全恢复 。 所以 , 基于使用NAPs或是STOPS的候选乙肝新药物之后 , 可能还需要进行额外的联合用药来启动HBV特异性T细胞功能 , 最大限度地提高对免疫恢复的影响!
【核苷酸|乙肝药物设计者思路,基于抑制蛋白输出,细分NAP与STOPS赛道进展】以上研究数据和结论 , 已可从本届欧肝会或国外药企查询得知 , 了解药物研究进展固然重要 , 深刻理解药物设计者的药物开发思路其实更重要 。 因为这些思路不是经过1-2次实验得到的 , 当中凝结着广大药物工作者经过反复试实验失败后找到的可行方法 。 新药研发如果不做就只有0 , 如果去做了才可能实现0-1!
推荐阅读
- 一年运输16位宇航员和12吨货物,SpaceX的载人航天技术已炉火纯青
- 三万年前的手印
- 两轮交锋:新冠病毒“实验室泄漏论”在科学上无效
- 细胞、细胞核、DNA、染色体傻傻分不清?一张图搞明白
- 什么是量子纠缠?为何爱因斯坦称之为“超距离的幽灵效应”?
- 核苷酸 NMNH问世,辅酶前沿技术再刷新!
- 乐城 研究报告揭示人类基因奥秘,进化最快的基因都与大脑发育有关?
- 基因 非甩锅!论文出现硬伤,责任真不在我
- 苏铁 连续获得临床批件!国内间充质干细胞转化应用将走向大众






