文章图片
文|陈根
每到夏季 , 中暑的人总不在少数 , 热射病就是一种重症中暑 。 根据美国流行病学数据 , 热射病一旦诱发热衰竭 , 死亡率能达到63.2% 。 在过去的20年里 , 破纪录的热浪在全球范围内导致许多与热有关的死亡病例 , 随着全球气候的持续变暖 , 热射病可能成为威胁人类生命的一大疾病 。
从前 , 科学家们认为热射病是一个物理性损伤过程 , 高热产生细胞毒性作用 , 当人体内温度持续升高达到一定的阈值时 , 会直接导致细胞产生不可逆性损伤 , 继而引发全身多脏器功能衰竭 。 尽管临床上采取积极的降温治疗并实施脏器支持处理 , 但热射病的死亡率仍然居高不下 。
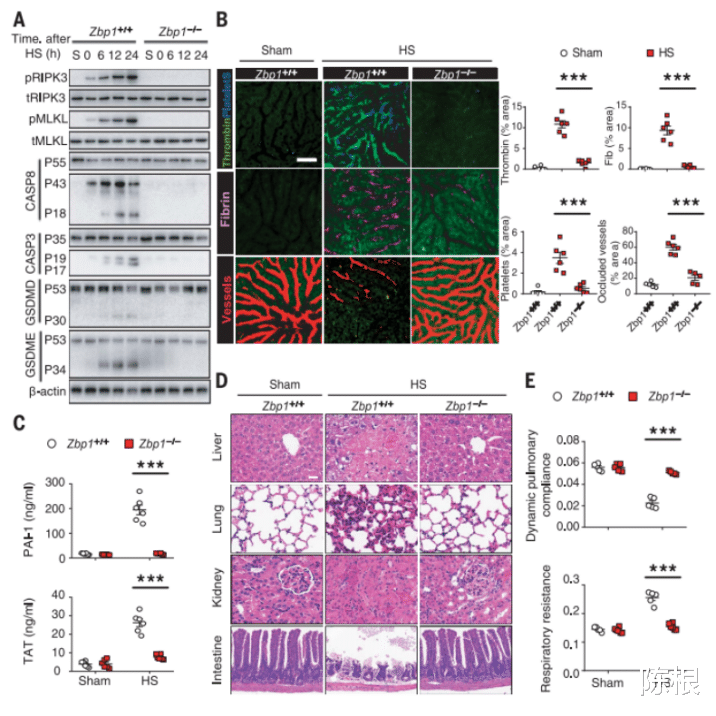
近日 , 中南大学的研究人员对热射病进行了细致研究 , 发现热射病是高体温通过Z-DNA结合蛋白-1(ZBP1)诱发过度的程序性细胞死亡 , 进而导致危及生命的弥散性血管内凝血(DIC)与多脏器损伤 。
具体来说 , 细胞死亡是生物生命过程中重要的生理现象 。 基于不同的分类标准 , 可分为程序性死亡和非程序性死亡 。 程序性死亡是细胞的正常凋亡 , 对于生物成长发育和正常活动十分重要 , 而过度的细胞程序性死亡会带来身体衰竭 。
为了研究程序性细胞死亡在热应激中的作用 , 研究人员采用了四种基因敲除或突变小鼠 , 分别为RIPK3基因缺失(Ripk3-/-)小鼠 , MLKL基因缺失(Mlkl-/-)小鼠 , MLKL及caspase 8基因缺失(Mlkl-/-Casp8-/-)小鼠 , RIPK3激酶域突变(Ripk3Δ/Δ)小鼠 。
结果发现 , 高体温通过RIPK3途径而非HMGB1-caspase-11途径诱发多种程序性细胞死亡 , 进而导致DIC与多脏器损伤 。 此外 , 高体温诱导了肝、肺及肠等器官组织中RIPK3和MLKL的磷酸化 , 以及caspase-8等凋亡相关蛋白的剪切 , 敲除RIPK3基因确实能防止高体温诱发多脏器损伤与死亡 。
随后 , 该研究人员又采用了 ZBP1 基因缺失(Zbp1-/-)小鼠 , 并将 Zbp1-/-小鼠及其对照野生型小鼠置于高温高湿环境下诱发热应激反应 。 结果表明 , 热应激通过 ZBP1 介导 RIPK3 激活 , 从而促进热应激病理特征的发展 。
【陈根:中国科学家,揭示热射病致死机制】未来 , 该研究或可减少热射病带来的相关伤亡 。
推荐阅读
- 记性差和肠道细菌有什么关系?科学家发现逆转记忆衰退的新方法
- 切尔诺贝利地下依然暗藏危机?形似象脚的熔毁炉芯,为何会复燃?
- 光速为什么可以这么快? 它的动力源是什么?
- 站着睡觉,踢飞狮子,凶猛的长颈鹿是如何交配的?
- 圆周率被算到31.4万亿位,它的终点是宇宙奇点?爱因斯坦说对了?
- 地球上本没有人类,那么第一个人如何而来?科学家揭开谜底!
- 喝1400杯镭水而死,他为何要这样做?传说很补
- 外星人在打仗?中国天眼探测到一次极端宇宙爆发,47天发生1652次爆炸!
- 神秘百慕大三角之谜已解?全因“人为错误”所致




