
文章图片
【维真生物】提供现货产品、载体构建、病毒包装、细胞系建立等服务
实验原理
SDS聚丙烯酰胺凝胶电泳技术首先在1967年由Shapir0建立 , 其原理:聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr)和交联剂N , N’一亚甲基双丙烯酰胺(简称Bis)在催化剂过硫酸铵(APS) , N , N , N’ , N’四甲基乙二胺(TEMED)作用下 , 聚合交联形成的具有网状立体结构的凝胶 , 并以此为支持物进行电泳 。
丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带 , 如果分离纯化的样品中只含有同一种蛋白质 , 蛋白质样品电泳后 , 就应只分离出一条区带 。 SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键 , 并按一定的比例和蛋白质分子结合成复合物 , 使蛋白质带负电荷的量远远超过其本身原有的电荷 , 掩盖了各种蛋白分子间天然的电荷差异 。 因此 , 各种蛋白质 SDS复合物在电泳时的迁移率 , 不再受原有电荷和分子形状的影响 , 只是分子量的函数 。 这种电泳方法称为SDS聚丙烯酰胺凝胶电泳(简称SDS-PAGE) 。 由于SDS-PAGE可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以忽略不计的程度 , 因此常用来鉴定蛋白质分离样品的纯化程度 , 如果被鉴定的蛋白质样品很纯 , 只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质 , 那么 SDS-PAGE后 , 就只出现一条蛋白质区带 。 SDS-PAGE可分为圆盘状和垂直板状、连续系统和不连续系统 。 本实验采用垂直板状不连续系统 。 所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH和凝胶孔径等所组成 。
实验材料
(一)试剂
1、30%丙烯酰胺混合液(Acr:Bis 为 29:1) 称取丙烯酰胺(Acr ) 29g 及甲叉丙烯酰胺(Bis ) 1.0g ,用 去离子水溶解并稀释至 100ml ,贮棕色瓶中于 4℃保存,可用一个月 。
【电荷|知识分享:SDS-PAGE的配制及电泳】2、1.5mol/L pH8.8 Tris-HCl缓冲液 取 1mol/L HCL溶液 48ml 、三羟甲基甲烷(Tris ) 36.6g ,加双蒸馏水 至 80ml 使其溶解,调 pH 至 8.8,然后用双蒸馏水稀释至 100ml ,置棕色瓶中, 4℃贮存 。
3、1.0mol/LpH6.8Tris-HCl缓冲液 取 1mol/L HCL溶液 48ml , Tris5.98g , 加双蒸馏水至 80ml , 调 pH6.8, 用双蒸馏水稀释至 100ml ,置棕色瓶中, 4℃贮存 。
4、Tris-甘氨酸电泳缓冲液 称取 Tris 6g、 甘氨酸 28.8g , 加蒸馏水 850ml , 调 pH 至 8.3, 加蒸馏水到 1000ml , 4℃贮存 。 用时可做 10倍稀释 。
5、10% 过硫酸铵(AP )(6)四甲基乙二胺(TEMED )或 β-二甲基氨基丙腈(DMAPN ) 。
6、10%SDS(十二烷基磺酸钠) 称取 SDS 10g,加蒸馏水 100ml 使其溶解 。
7、四甲基乙二胺(TEMED )
8、上样缓冲液 取 1.0mol/LpH6.8Tris-HCl缓冲液 6.25ml ,蔗糖 10g , SDS 2.3g, 1g/L溴酚蓝 10ml ,加 蒸馏水溶解,混合至 100ml 。
9、考马斯亮蓝染色试剂 考马斯亮蓝 R250染色液:浓度为 2.5g/L,用甲醇∶醋酸∶蒸馏水 =5∶ 1∶ 5的溶 液配制(V/V) 。
10、脱色液:取冰醋酸 7.5ml 、甲醇 5ml ,加蒸馏水至 100ml 。
11、蛋白质分子量标志物 市售中分子量蛋白质分子量标志物 。 也可选择 5种以上的已知分子量蛋白质自 行配制,注意其分子量分布要能满足需要,各种蛋白质的浓度基本相等 。
(二)仪器
圆盘电泳槽(或垂直板电泳槽)、稳压稳流电泳仪 、脱色摇床 。
SDS-PAGE蛋白质电泳步骤
将收集的各样品加入等体积的2×SDS-PAGE Loading Buffer , 煮沸裂解5min , 冰浴2min , 12,000rpm离心10min , 取上清-20℃保存备用 。
1)按照电泳装置的使用说明 , 装好洁净干燥的玻璃板 。
2)分离胶的制备
按下列成分配制10mL 12%分离胶:

文章图片
各成分加入后迅速旋涡混匀 , 用微量移液器将其小心地注入准备好的玻璃板间隙中 , 并为积层胶留出足够空间 。 轻轻在顶层加入一薄层水封顶 , 以防止空气中的氧对凝胶聚合的抑制作用 。 凝胶聚合完成后 , 倒掉覆盖的水层 , 用水清洗凝胶顶部数次 , 用滤纸吸干凝胶顶端的水 。
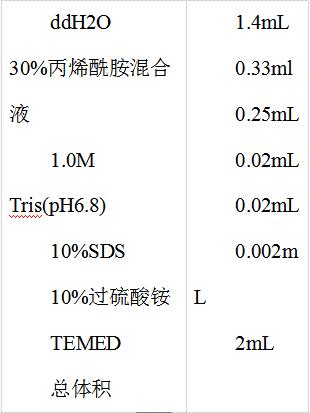
3)积层胶的制备
按下列成分配制2mL 5%的积层胶:
文章图片
各成分加入后迅速旋涡混匀 , 用微量移液器将其灌注到分离胶上 , 灌满后小心插入加样梳 , 尽可能避免产生气泡 。
4)待积层胶凝固后 , 小心拔下梳子 。
5)将凝胶固定于电泳装置上 , 加入足量的1×Tris-甘氨酸电泳缓冲液 , 在加样孔中分别加入20μL各样品 。
6)样品在积层胶中电泳时 , 使用80V电压 , 待溴酚蓝带进入分离胶后 , 将电压升至120V , 继续电泳直至溴酚蓝带到达分离胶的底部且开始泳出胶底面 , 关闭电源 。
7)卸下凝胶 , 将其浸泡在至少5倍体积的考马斯亮蓝R-250染色液中 , 置水平摇床上室温染色至少4h , 之后取出染色的凝胶并回收染液 , 以备再用 , 将凝胶浸泡于考马斯亮蓝脱色液中 , 在水平摇床上脱色4-8h , 其间更换脱色液3-4次 , 直至凝胶脱色到条带清晰为止 , 观察记录结果并拍照 。
注意事项
1、做胶:防止漏胶、进气泡以及花胶(水封、插梳子和拔梳子) 。
2、加样:两边加loading , 加样量一样 , 加样时间要尽量短 , 以免样品扩散 。
3、电泳:将胶夹好放于电泳槽中 , 加电泳buffer(内外面不能联通) , 将电压调到90V开始电泳 。
4、本法也适合于其他生物样品中蛋白质的分析 。 上样量不宜过大,否则会出现过载现象 。 尤其是考马斯亮 蓝 R250染色, 在蛋白质浓度过高时, 染料与蛋白质的氨基 (-NH) 形成的静电键不稳定, 其结合不符合 Beer 定律,使蛋白质量不准确 。
5、Acr 和 Bis 有神经毒性,可经皮肤、呼吸道等吸收,故操作时要注意保护 。

文章图片
【维真生物】提供现货产品、载体构建、病毒包装、细胞系建立等服务
备注:维真生物公司致力于为广大科研工作者提供优质的病毒包装服务 , 服务项目包括:科研级和临床级腺病毒、慢病毒、腺相关病毒(AAV)的包装、质粒载体构建、TALEN 基因敲除、基因突变等 。 目前为止公司已经拥有人源现货质粒库(18 000个)、腺病毒现货库(12 000个)、腺相关病毒(AAV)现货库 , 公司还拥有丰富的定制服务项目 。 真诚欢迎您咨询与选购!
推荐阅读
- 新机|快准稳,捕捉每个高光瞬间! 刘衡分享EOS R5拍摄体验
- 问答|紧追B站加码知识类内容,抖音上线“学习频道”
- 显示器|华光昱能知识--DP2.0跟DP1.4有那些不一样?
- 审判|直接服务“三城一区”主平台,怀柔科学城知识产权巡回审判庭成立
- 词条|百度百科上线2500万词条,超750万用户参与共创科普知识内容
- 风险|筛选风险词、用实体类型推断限售商品,阿里安全夺冠知识图谱大赛
- 字节跳动|抖音上线学习频道,为知识内容增加一级入口
- 知识科普|直管内径、凸缘管内径密封快速接头 管内壁粗糙的管口格雷希尔GripSeal连接器
- 训练|华为运动健康 Beta 新版本测试:新增健身课程分享、血压挑战计划
- 声音|魏晨分享视频感谢粉丝,手机录视频无修音唱歌,瘦到面部凹陷






