文章图片
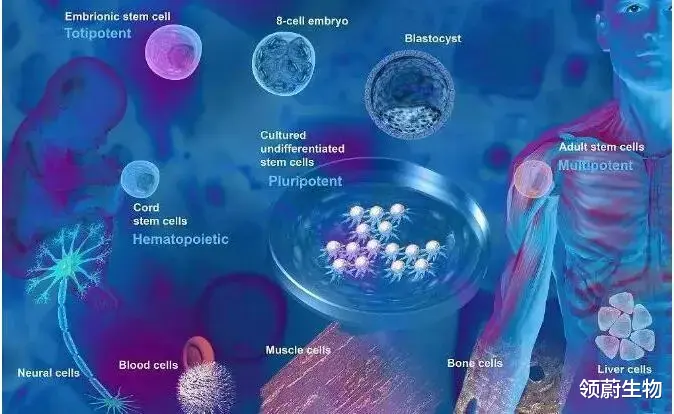
间充质干细胞(mesenchymal stem cells , MSCs)是中胚层中具有高度自我更新和多向分化潜能的多能干细胞 , 广泛存在于全身多种组织中 , 可在体外培养扩增 , 并能在特定条件下分化为神经细胞、成骨细胞、软骨细胞、肌肉细胞、脂肪细胞等 。
MSCs是多能干细胞 , 具有“横向分化”或“跨系分化”的能力 , 因此其具有广阔的临床应用前景 , 是细胞替代治疗和组织工程学的首选种子细胞 。
MSCs作为机体的一种成体干细胞 , 最早在骨髓基质中发现 , 近年来随着研究的深入 , 在脐血、胎盘、胎儿肺组织、脐带、脂肪、胰腺、甚至月经血中均可以培养出MSCs 。 研究还发现 , 不同来源的MSCs 的表面标记及生物学特性(造血支持、多向分化脂肪生成、骨生成、软骨生成、免疫抑制及组织修复等)也不尽相同 , 在生物学特性方面存在着较大差异 。
今天我们分别从MSCs的表面标记物、增殖能力、分化能力、迁移能力来分析一下不同种类间充质干细胞之间存在什么样的差异 。
1、表面标记物方面的差异
细胞表面标记物可以体现细胞的一些基本特征 。 MSCs的表面标记物基本要求是:表达白细胞分化抗原(CD)105、CD73、CD90 , 不表达CD45、CD34、CD14 或 CD11b、CD79a 或 CD19 。
细胞的表面标记物往往与特定的功能相关 , MSCs表面除了表达一些成体干细胞的表面标记物外 , 还表达一些与细胞黏附、趋化及免疫调节相关的免疫标记 , 不同组织来源的MSCs的表面标记可能存在或多或少的差异 。
对骨髓、脐带、胎盘、脂肪组织等来源的MSCs进行比较发现CD133 在骨髓、脐带、胎盘来源的MSCs中不表达 , 而在脂肪来源的MSCs中表达 , CD133为神经胶质瘤的表面标记物 , 表明上述3种来源的MSCs具有向神经胶质细胞分化的潜能 。 脐带MSC高表达CD106 , 其次是骨髓 MSCs , 脂肪MSCs不表达;CD106主要存在于人类足月胎盘 , 其具有强大的免疫活性 , 是胎盘屏障的组成部分 。
2、增殖能力的比较
不同组织来源的MSCs体外扩增的能力也不完全相同 。
脐带MSCs与骨髓MSCs相比 , 脐带组织提取物的MSCs量很高 , 并且脐带MSCs具有更高的增殖能力 , 在长期传代30次之后 , 脐带MSCs增殖能力未发生明显改变 。 而骨髓MSCs在传代6次以后就表现出增殖能力减弱、倍增时间延长 。 这说明了脐带MSCs具有比骨髓MSCs更强的增殖能力 。
相关研究证明脐带MSCs比骨髓MSCs的增殖速度要快 , 两者倍增时间分别为28h与39h 。 从人脐带和脂肪中成功提取出MSCs , 发现脐带和脂肪来源的MSCs的增殖能力比骨髓MSCs强得多 , 且脐带来源的MSCs增殖能力更为突出 , 分别为: (2.0±0.04)d 与(2.7±0.03)d 。
脐带来源的MSCs具有更强的扩增能力 , 且经过扩增后MSCs的基本性质没有发生变化 , 并且没有伦理学的限制 , 这样就可以从同一样本中得到大量的 MSCs而满足临床细胞治疗的需要 。 因而相对于增殖较慢的成体来源的干细胞 , 脐带来源的MSCs具有其独特的优势 。
3、分化能力的差异
MSCs需具有向骨、脂肪、软骨的分化能力 , 这些分化的组织都属于中胚层 。
最近的研究表明 , MSCs可能不仅仅具有向中胚层细胞分化的能力 , 也具有向内胚层和神经外胚层分化的能力 , 包括向神经细胞、肝细胞和内皮细胞分化等 。
骨髓来源的MSCs在临床使用中存在着如细胞数量少和分化潜能随着年龄下降等局限性 。 脐带MSCs具有向骨、软骨分化的能力 , 并且在相同的成骨条件下 , 脐带MSCs具有更快的成骨速度 , 具有更多的碱性磷酸酶(ALP)细胞和骨节形成 , 分析可能是最开始提取时 , 脐带MSC 相对于骨髓MSCs可能具有更多的骨前体细胞 。
脐带MSCs与骨髓MSCs一样 , 能够向软骨细胞分化 , 因而也是可用于软骨修复的细胞 。 脐带MSCs在一定条件下可分化为肌细胞、成骨细胞、神经细胞、肝细胞等 。
与骨髓MSCs相比 , 脐带MSCs更为原始 , 免疫原性较弱 , 不表达主要组织相容性复合基因(MHC)Ⅱ类分子和死亡因子配体(FasL) , 不表达 MHCⅠ类分子 , 也不表达白细胞分化因子7-1 (B7-1)、B7-2、CD40、CD40L 等分子 , 具有逃避免疫监视 , 来源广泛 , 数量多 , 分化能力强 , 易于采集和保存等优点 。
4、迁移能力比较
研究表明 , MSCs可以向炎症部位或是损伤部位迁移 , 到达炎症部位后抑制炎症反应 , 并对损伤部位进行修复 。
推荐阅读
- 中科西部干细胞研究院:干细胞如修理大师,调整失控的免疫系统!
- 中科西部干细胞研究院:胎盘干细胞为家人健康保驾护航
- 干细胞抗衰老到底靠不靠谱?看看基础理论研究得到的是怎样的结论
- 4岁男童被拐,在买家泪忍14年,内心的苦楚又有谁能理解?
- 关于间充质干细胞治疗卵巢早衰作用机制的探讨
- 国内干细胞治疗帕金森病最新临床研究进展
- 科普了解什么是干细胞?干细胞知识汇总来了!
- 超级星舰很快点火发射,马斯克移民火星计划成败在此一举
- 牛爱芳还在,又来一个小凤!6胎母亲在家生产,女儿脐带绕颈夭折